 Che cosa sappiamo dell’IDROSSICLOROCHINA? Perché vietarne l’autorizzazione all’uso nell’ambito della cura del COVID-19 se è stata usata con successo in Italia e in molte altre nazioni d’Europa e del mondo?
Che cosa sappiamo dell’IDROSSICLOROCHINA? Perché vietarne l’autorizzazione all’uso nell’ambito della cura del COVID-19 se è stata usata con successo in Italia e in molte altre nazioni d’Europa e del mondo?
SCARICA LA LIBERATORIA PER IL TUO MEDICO CURANTE
In piena crisi da COVID-19, l’uso di clorochina e idrossiclorochina nella prevenzione o per il trattamento dei pazienti è consentito in più paesi, ma è rimasto al centro di molte polemiche negli ultimi mesi.
Questo articolo si pone come obbiettivo di descrivere le proprietà della clorochina e dell’idrossiclorochina e mette in evidenza non solo i loro effetti antivirali, ma anche le loro importanti proprietà immunomodulatrici ed anti-infiammatorie.
Per fare questo occorre parlare del COVID-19 suddiviso nelle sue tre fasi di evoluzione patogenetica:
- Fase 1) è quella in cui prevale la replicazione virale (il virus entra nel nostro organismo e si replica all’interno delle cellule). Può non dar luogo a sintomi oppure darne di simili a quelli delle classiche sindromi influenzali. La sua prognosi è ottima, il decorso è benigno e si manifesta in circa l’95% dei contagiati;
- Fase 2) è quella della “famosa” polmonite interstiziale, che colpisce spesso e in modo esteso entrambi i polmoni, in cui si ha una prima risposta infiammatoria e sintomi respiratori anche molto importanti. La prognosi in questa fase è variabile, spesso si rende necessario il ricovero ospedaliero.
- Fase 3) può presentarsi in un numero ridotto di pazienti, è caratterizzata da un quadro clinico ingravescente causato da una iper risposta infiammatoria (la tempesta citochinica) che determina, tra l’altro, un quadro di Coagulazione Intravascolare Disseminata (CID). In questo caso la prognosi è severa.
Va detto che da parte dell’OMS non è mai stata data alcuna direttiva in merito ad un protocollo specifico ed efficace da applicare in caso di COVID-19. Anzi ricordiamo espressamente che ad inizio epidemia si sconsigliavano TUTTI I tipi di anti-infiammatori, scelta che si rivelerà disastrosa…
Fortunatamente, su base nazionale, diverse associazioni mediche individuarono protocolli vari da utilizzare per affrontare la patologia. Anche se differenti da Paese a Paese (ed all’interno di uno stesso Paese spesso erano diversificate tra ospedale e ospedale, regione e regione) mantenevano, tuttavia un approccio simile che prevedeva l’abbinamento, in fase iniziale di malattia, di farmaci che congiuntamente esplicassero una azione immuno-modulante e antivirale.
A partire dalle prime settimane di Marzo 2020, per affrontare ciascuna delle tre fasi di malattia, ogni terapia assegnata domiciliarmente o presso le strutture ospedaliere, faceva riferimento ad una combinazione di farmaci che si presentava simile, quando non addirittura coincidente, in più parti del mondo. Solitamente nelle prime settantadue ore dall’insorgenza dei sintomi i pazienti venivano trattati a domicilio abbinando l’idrossiclorochina ad un antibiotico, specificatamente l’azitromicina. Mentre all’aggravarsi dei sintomi e durante l’ospedalizzazione, si aggiungeva, ai farmaci utilizzati in fase precoce, l’utilizzo di cortisone e di eparina a basso peso molecolare (EBPM).
A tale mix di farmaci si aggiunse poi, a macchia di leopardo, nei territori e negli ospedali, l’utilizzo di plasma iperimmune di persone guarite. Si è assistito ad un fenomeno, forse unico nella storia della medicina cioè ad una convergenza della pratica medica a livello mondiale, basata sulle evidenze cliniche sperimentate sul campo. Insomma, pur in assenza di una direttiva dell’Organizzazione Mondiale della Sanità le diverse esperienze nazionali dell’intero pianeta convergevano verso il medesimo approccio: un mix di farmaci che, sinergicamente, rispondessero alla replicazione virale, all’eccessiva risposta immunitaria aspecifica, alla coagulazione intravascolare; ciascun farmaco con un suo proprio ruolo specifico. Questo utilizzo clinico nei vari territori internazionali aveva a suo fondamento plurimi studi prodotti nell’ultimo decennio che attestavano l’efficacia antivirale del principio attivo contenuto nell’idrossiclorochina, nei confronti del virus Sars, di cui il SARS-CoV-2 è parente stretto.
Su questi studi si è basata quindi la strategia terapeutica utilizzata per esempio l’IHU Méditerranée Infection a Marsiglia in Francia e in tutte quelle realtà che a tale esperienza si sono ispirate. Inoltre era conoscenza dei clinici specialisti in patologie respiratorie, il sinergico funzionamento tra i suddetti principi attivi e quelli di specifici antibiotici con attività immunomodulante e con anticoagulanti, tutti insieme fondamentali per la cura di sintomi simili a quelli provocati dal SARS-CoV-2, che pur essendo di altra natura eziologica (come il Mycoplasma pneumoniae), provocano al polmone danni paragonabili a quelli prodotti dal COVID-19.
Proprio all’interno di tali protocolli iniziò a farsi strada l’approccio basato su clorochina (CQ) ed idrossiclorochina (HCQ), farmaci economici, vastamente reperibili, ben noti e dal rapporto efficacia/sicurezza ben prevedibile.
Ad oggi questi farmaci sono licenziati e prescritti con buon successo terapeutico, da soli o in sinergia con altri farmaci per patologie autoimmuni tra queste, artrite reumatoide e Lupus eritematoso.
La CQ sembra inibire “in vitro” la replicazione del virus SARS e interferire con il recettore SARS-CoV2 (ACE2) tramite glicosilazione di quest’ultimo. Tali dati “in vitro” riportano che la CQ è in grado di bloccare la replicazione virale di SARS-COV-2 a dosi utilizzate nella pratica clinica.
Studi “in vivo” dimostrano come CQ e HCQ, inoltre, impediscono l’attività lisosomiale e l’autofagia, determinando una diminuzione dell’elaborazione e della presentazione dell’antigene.
Sono anche note per interferire con la segnalazione dei recettori endosomiali e con i sensori citosolici degli acidi nucleici; questo si traduce in una diminuzione dell’attivazione cellulare e quindi nella minor secrezione di citochine infiammatorie ed interferone I, quindi azione antinfiammatoria.
Altri studi avvenuti su pazienti in stati critici affetti da Sars Cov2 dimostrano anche una minor produzione di IL6 (altro fattore pro infiammatorio).
QUI potete scaricare la LIBERATORIA AL MEDICO CURANTE per la prescrizione del PROTOCOLLO DOMICILIARE COVID-19
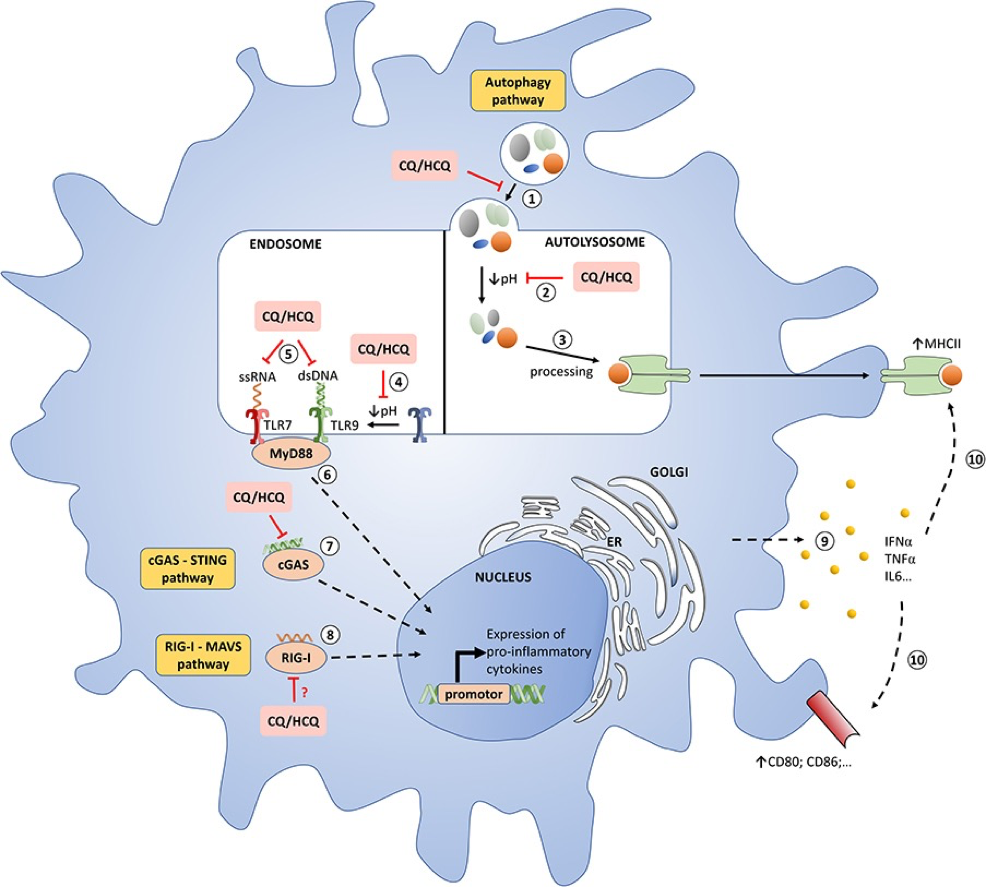
Figura 1. Meccanismi molecolari di clorochina / idrossiclorochina in pDC.
- (1)Fusione autofagosoma-lisosoma. CQ / HCQ compromette questo passaggio.
- (2) Degradazione del carico da autofagosoma.CQ / HCQ si accumulano nei lisosomi (lisosomotropismo) e ne inibiscono la funzione aumentando il pH.
- (3) Gli antigeni vengono elaborati su MHC classe II.
- (4) La proteolisi dei TLR da parte delle proteasi acido-dipendenti è un passaggio essenziale per il riconoscimento dei ligandi. CQ / HCQ inibiscono le proteasi acido-dipendenti aumentando il pH.
- (5) I TLR interagiscono con gli acidi nucleici presentati ai compartimenti endosomiali. HCQ e CQ possono legarsi direttamente agli acidi nucleici, impedendone il riconoscimento e inibendo le interazioni TLR-ligando.
- (6)L’attivazione dei TLR porta al reclutamento di MyD88 con una successiva sintesi di citochine pro-infiammatorie, in particolare IFN-I.
- (7) Il DNA citosolico si lega al cGAS, che quindi sintetizza il secondo messaggero cGAMP per mediare la trascrizione dell’IFN-I dipendente da STING. HCQ e CQ bloccano il legame di dsDNA / cGAS, attenuando così l’attivazione sottostante della via STING mediata da cGAMP.
- (8) L’ RNA citosolico viene riconosciuto da RIG-I, il segnale viene trasferito a MAVS, quindi ai successivi interattori che portano all’espressione di IFN-I.CQ / HCQ può compromettere questo processo.(9e10) Il rilascio di IFNα, tra le altre citochine, stimola un’attivazione di feedback con in particolare la sovraregolazione di MHCII e molecole co-stimolatorie.
Legenda: CQ: clorochina; dsDNA, DNA a doppio filamento; ER, reticolo endoplasmatico; HCQ: idrossiclrochina; IFN-I: interferoni di tipo I; MHC: complesso istocompatibile maggiore; pDC: cellula dendritica plasmacitoide; TLR: recettore Toll-Like.
Non per ultimo sarebbe da sottolineare che HCQ e CQ nella loro distribuzione tissutale corporea si concentrano in particolare nei polmoni.
Date le proprietà antivirali e antinfiammatorie di CQ ed HCQ, sembra ragionevole usarle contro l’infezione da SARS-CoV2.
Da dove nasce dunque il divieto di AIFA di continuare a concedere ai medici un uso off-label (non licenziato per tale manifestazione patologica)?
Facciamo un po’ di chiarezza riesaminando quanto accaduto finora:
– nelle fasi preliminari della pandemia, e sulla base di diversi studi e trattamenti effettuanti su pazienti Covid19 in diversi paesi del mondo, AIFA concede l’ uso non licenziato (off-label) del farmaco, che (oltre gli eccellenti risultati ottenuti in Italia dal Dott. Cavanna ed altri) ha ottenuto un significativo successo anche in diversi stati europei e non, con riduzione della mortalità dal 47% (pazienti non trattati con HCQ) al 18% pazienti trattati con HCQ (1)
I pazienti di questi studi hanno ricevuto sempre dosi non superiori a 200mg due volte al giorno di Idrossiclorochina per tempi che andavano dai 5 ai 7gg, in associazione ad altri farmaci quali antibiotici, corticosteroidi, ed ove necessario e previsto anche altri anti virali, antiaggreganti o trombolitici;
– successivamente, l’AIFA (seguendo indicazione dell’OMS, di cui si ricorda i coniugi Gates sono i più grandi finanziatori dopo il ritiro degli USA) ritira la concessione di uso di HCQ off-label sulla base di altri studi (principalmente USA e britannici) che evidenziavano il verificarsi di severi effetti collaterali, tipici e già noti, dell’ HCQ.
Gli studi comprendenti l’idrossiclorochina furono così interrotti dall’OMS già il 25 Maggio 2020 dopo la pubblicazione di un articolo su The Lancet, in cui si affermava che i pazienti che avevano ricevuto idrossiclorochina presentavano tassi di mortalità del 35% per gravi aritmie cardiache.
Questa pubblicazione veniva ritirata dagli stessi autori dopo tredici giorni dalla sua uscita (N1) perché contestata da 120 scienziati di varie nazionalità, sia per la raccolta dei dati che per la metodica e il 2 Giugno 2020 anche ottanta medici italiani inviavano una lettera, alla rivista The Lancet e all’OMS, contestandola nel suo contenuto scientifico. Il Dott. Tedros Adhanom Ghebreyesus, direttore generale dell’OMS, consentiva quindi il 3 Giugno 2020 la ripresa degli arruolamenti dei pazienti in sperimentazioni con l’idrossiclorochina nello studio Solidarity.
Un successivo studio, RECOVERY, condotto ad Oxford e finanziato da Bill Gates tramite la fondazione “Bill e Melinda Gates” (per pura coincidenza?!) è diventato poi lo studio principale su cui l’OMS ha basato la sua decisione finale per confermare a tutte le agenzie del farmaco la sospensione dell’uso dell’idrossiclorochina per il COVID-19.
RECOVERY come vedremo è stato ampliamente confutato…
Vediamo come infatti un più recente studio indiano pubblicato sull’International Medical Journal del 29/09/2020 dal team del Dott. Dilip Pawar (pluripremiato scienziato, Responsabile di Medicina Generale, Farmacologo clinico, Ricercatore scientifico sul cancro e, più recentemente, esperto per il COVID-19 a Mumbai, India) che ne mostra due indiscutibili debolezze chiave:
1) nello studio è stata utilizzata la monoterapia (basata su HCQ), in stadi molto più che avanzati della malattia, mentre nella maggior parte dei paesi è stata utilizzata la combinazione di HCQ in sinergia con diverse terapie ed a stadi non tardivi;
2) è stato utilizzato un dosaggio elevatissimo di idrossiclorochina: Il protocollo del Recovery ha utilizzato un dosaggio di 2400 mg di idrossiclorochina nelle prime 24 ore di trattamento. La dose iniziale è stata poi seguita dalla somministrazione di 400 mg ogni dodici ore per altri nove giorni, per un totale di 9,6 g di farmaco in dieci giorni. Di conseguenza, a causa dell’elevata dose di utilizzo di HCQ, nello studio sono stati osservati più eventi avversi e mortalità.
Per paragone il gruppo del prof Didier Raoult in Francia ha usato 600 mg al giorno per un massimo di dieci giorni in 1061 pazienti con COVID-19, riportando 8 decessi ed un tasso di mortalità dello 0,75%, nonostante anche questo possa essere ritenuto “alto dosaggio”. Va inoltre fatto notare che nello stesso periodo, le esperienze territoriali italiane hanno visto un impiego di idrossiclorochina al dosaggio giornaliero di 400 mg, quindi ampliamente entro il sicuro regime terapeutico.
Diciamocelo subito, con sereno spirito critico, le conclusioni sono sotto gli occhi di tutti: gli studi che OMS passa e che quindi AIFA considera negativamente, usandoli come giustificazione al ritiro dell’autorizzazione, sono studi che prevedono un dosaggio di HCQ almeno doppio del normale massimo (800mg) e che toccano addirittura i 2400mg (sei volte il massimo dosaggio terapeutico che è di 400mg) nello studio RECOVER. Questo già di per sé ha un significativo impatto clinico, se poi ci mettiamo che la terapia fosse protratta per più dei 5/7 gg rispetto agli altri studi e che i pazienti fossero in stati avanzati di malattia, facilmente si spiega la maggiore incidenza di effetti collaterali anche seri (N.B. gran parte di questi rientrano a sospensione terapia).
Un’ altra cosa che sarebbe interessante notare è che benchè HCQ e CQ abbiano una azione antivirale, anti-infiammatoria, ed immuno modulante, nel trattamento di pazienti Covid-19, sono queste ultime due ad avere una maggiore incidenza nel recupero dello stato di salute, mentre l’azione antivirale sarebbe utile solo a scopo profilattico, ma a dosaggi che renderebbero, di poco, ed in base al soggetto trattato, meno sicuro il suo utilizzo… eppure in parte degli studi che ancora una volta AIFA ritiene giusto seguire vengono considerate le “scarse” doti antivirali di HCQ, senza tener presente che per salvar vite preziose fossero doti meno rilevanti.
Viene lecito chiedersi se non sarebbe forse stato più utile che AIFA avesse creato dei gruppi di esclusione e/o monitoraggio per pazienti a maggior rischio di manifestazione di effetti quali cardiopatie, retinopatie, ipoglicemia e insufficienze renali od epatiche invece di ritirare la sua autorizzazione.
Fortunatamente in ambito europeo EMA non vieta l’uso di HCQ e CQ ma lo sconsiglia soltanto, come AIFA stesso riporta nel suo comunicato, ed inoltre a tutela dei pazienti che volessero sottoporsi a trattamento “sperimentale” con HCQ esiste una LIBERATORIA (a fondo pagina) da firmare e consegnare al medico di scelta (QUALUNQUE MEDICO non necessariamente quello di famiglia del SSN) che serve a tutelare il professionista da una eventuale azione “punitiva” governativa, benché in Italia esista ancora (fino a quando?) la libertà di scelta di cura da parte del paziente ed una assoluta discrezionalità di scelta terapeutica del medico insita nelle capacità del professionista “…di agire in scienza e coscienza…”.
Un detto di saggezza popolare dice: “tra due diavoli, fidati di quello che conosci”, eppure pare che ratio e saggezza non facciano parte del modo di agire attuale dove si invoca ed aspetta l’arrivo di vaccini non testati a lungo termine mentre si affossa e proibisce l’utilizzo di un farmaco noto, efficace, e sicuro entro certi limiti, da ben oltre sessantacinque anni.
Dott. Dario Aiello, Chimico Farmaceutico, Ordine dei Farmacisti Belluno, membro del General Pharmaceutical Council (GPhC) britannico per Commissione Ars Medica R20202
QUI potete scaricare la LIBERATORIA AL MEDICO CURANTE per la prescrizione del PROTOCOLLO DOMICILIARE COVID-19
Note:
N1 https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31180-6/fulltext
Referenze indispensabili alla stesura di questa recensione:
- Gautret P, Lagier J-C, Parola P, Hoang VT, Meddeb L, Mailhe M, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents.(2020) 105949. doi: 10.1016/j.ijantimicag.2020.105949. [Epub ahead of print].
- Chen Z, Hu J, Zhang Z, Jiang S, Han S, Yan D, et al. Efficacy of hydroxychloroquine in patients with COVID-19: results of a randomized clinical trial. medRxiv. [Preprint].(2020). doi: 10.1101/2020.03.22.20040758. [Epub ahead of print].
- Sarma P, Kaur H, Kumar H, Mahendru D, Avti P, Bhattacharyya A, et al. Virological and clinical cure in covid-19 patients treated with hydroxychloroquine: a systematic review and meta-analysis. J Med Virol. (2020). doi: 10.1002/jmv.25898
- Yu B, Li C, Chen P, Zhou N, Wang L, Li J, et al. Low dose of hydroxychloroquine reduces fatality of critically ill patients with COVID-19. Sci China Life Sci. (2020). doi: 10.1007/s11427-020-1732-2. [Epub ahead of print].
- Mahévas M, Tran V-T, Roumier M, Chabrol A, Paule R, Guillaud C, et al. Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data. BMJ.(2020) 369:m1844. doi: 10.1136/bmj.m1844
- Vincent Gies1,2,3*,Nassima Bekaddour4,5,Yannick Dieudonné1,2,6,Aurélien Guffroy1,2,6,Quentin Frenger1,7,Frédéric Gros1,7,Mathieu Paul Rodero4,5,Jean-Philippe Herbeuval4,5*†andAnne-Sophie Korganow1,2,6*† Beyond Anti-viral Effects of Chloroquine/Hydroxychloroquine. 1Université de Strasbourg, INSERM UMR – S1109, Strasbourg, France 2Hôpitaux Universitaires de Strasbourg, Department of Clinical Immunology and Internal Medicine, National Reference Center for Systemic Autoimmune Diseases (CNR RESO), Tertiary Center for Primary Immunodeficiencies, Strasbourg, France 3Université de Strasbourg, Faculty of Pharmacy, Illkirch, France 4Université de Paris, CNRS UMR-8601, Paris, France 5Team Chemistry & Biology, Modeling & Immunology for Therapy, CBMIT, Paris, France 6Université de Strasbourg, Faculty of Medicine, Strasbourg, France 7Université de Strasbourg, Faculty of Life Sciences, Strasbourg, France
- Rosenberg ES, Dufort EM, Udo T, Wilberschied LA, Kumar J, Tesoriero J, et al. Association of treatment with hydroxychloroquine or azithromycin with in-hospital mortality in patients with COVID-19 in New York State. JAMA. (2020). doi: 10.1001/jama.2020.8630. [Epub ahead of print].
- Tang W, Cao Z, Han M, Wang Z, Chen J, Sun W, et al. Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial. BMJ.(2020) 369:m1849. doi: 10.1136/bmj.m1849
- Geleris J, Sun Y, Platt J, Zucker J, Baldwin M, Hripcsak G, et al. Observational study of hydroxychloroquine in hospitalized patients with covid-19. N Engl J Med.(2020) 382:2411–8. doi: 10.1056/NEJMoa2012410
- Boulware DR, Pullen MF, Bangdiwala AS, Pastick KA, Lofgren SM, Okafor EC, et al. A randomized trial of hydroxychloroquine as postexposure prophylaxis for Covid-19. N Engl J Med. (2020). doi: 10.1056/NEJMoa2016638
- Magagnoli J, Narendran S, Pereira F, Cummings T, Hardin JW, Sutton SS, et al. Outcomes of hydroxychloroquine usage in United States veterans hospitalized with Covid-19. medRxiv.(2020). doi: 10.1016/j.medj.2020.06.001
- Keyaerts E, Vijgen L, Maes P, Neyts J, Van Ranst M. In vitroinhibition of severe acute respiratory syndrome coronavirus by chloroquine. Biochem Biophys Res Commun.(2004) 323:264–8. doi: 10.1016/j.bbrc.2004.08.085
- Vincent MJ, Bergeron E, Benjannet S, Erickson BR, Rollin PE, Ksiazek TG, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread. Virol J.(2005) 2:69. doi: 10.1186/1743-422X-2-69
- Barnard DL, Day CW, Bailey K, Heiner M, Montgomery R, Lauridsen L, et al. Evaluation of immunomodulators, interferons and known in vitroSARS-coV inhibitors for inhibition of SARS-coV replication in BALB/c mice. Antivir Chem Chemother.(2006) 17:275–84. doi: 10.1177/095632020601700505
- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res.(2020) 30:269–71. doi: 10.1038/s41422-020-0282-0
- Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, et al. In vitroantiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin Infect Dis. (2020) ciaa237. doi: 10.1093/cid/ciaa237
- Liu J, Cao R, Xu M, Wang X, Zhang H, Hu H, et al. Hydroxychloroquine, a less toxic derivative of chloroquine, is effective in inhibiting SARS-CoV-2 infection in vitro. Cell Discov.(2020) 6:1–4. doi: 10.1038/s41421-020-0156-0
- Yang Z-Y, Huang Y, Ganesh L, Leung K, Kong W-P, Schwartz O, et al. pH-dependent entry of severe acute respiratory syndrome coronavirus is mediated by the spike glycoprotein and enhanced by dendritic cell transfer through DC-SIGN. J Virol.(2004) 78:5642–50. doi: 10.1128/JVI.78.11.5642-5650.2004